- Soutien aux équipes investigatrices
Accompagner les services cliniques dans la mise en œuvre des études :
- support aux médecins investigateurs pour mener les études en conformité avec les Bonnes Pratiques Cliniques et la règlementation en vigueur (ICH-GCP E6 R3)
- organisation des visites d’étude,
- préparation des documents et des outils nécessaires à la documentation attendue selon la règlementation.
- établissement des conventions avec le promoteur
- Gestion opérationnelle des inclusions
Assurer la bonne réalisation des études auprès des patients :
- identification et pré-sélection des patients,
- information et recueil du consentement de participation,
- planification et suivi des visites selon le protocole.
- Recueil et qualité des données
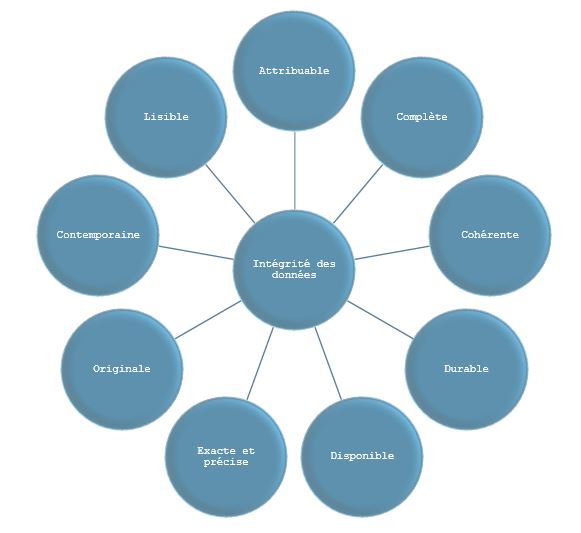
Garantir des données fiables, complètes et conformes selon les principes ALCOA+:
- saisie des données dans les eCRF,
- vérification des bonnes pratiques documentaires (source data vérification),
- gestion des écarts et actions correctives.
Intégrité des données : principes ALCOA, ALCOA+ et ALCOA ++ - La Qualité au Carré
- Respect du protocole et des bonnes pratiques
Sécuriser la conduite des études :
- application des procédures et exigences réglementaires,
- suivi des événements indésirables,
- gestion des échantillons biologiques
- respect des délais et des obligations de déclaration.
- Interface avec les promoteurs et les CRO (Clinical Research Organisation)
Assurer la transmission fluide d’informations :
- préparation et accompagnement des monitorings,
- réponses aux queries,
- coordination avec les différents interlocuteurs (promoteur, ARC moniteur, laboratoire…).
- facturation au promoteur selon la convention établie en début d’étude.
- Logistique et gestion du matériel d’étude
Organiser l’environnement nécessaire aux études :
- gestion des médicaments expérimentaux ou dispositifs,
- réception, traçabilité et stockage du matériel,
- commandes et retours selon les procédures.
- Contribution à la sécurité et au suivi clinique
Soutenir l’investigateur dans le suivi des patients :
- recueil des paramètres cliniques,
- remontée des événements indésirables,
- mise en œuvre des procédures d’urgence si requis par le protocole.